为了更好帮助学校科研团队开展优秀成果的宣传与推介,加速学校科技成果转化运用,中山大学科技园将持续征集并发布学校优秀科技成果。
成果一:一种光激活的交联蛋白前药纳米递药系统的制备及其应用
所属领域
生物医药
成果简介
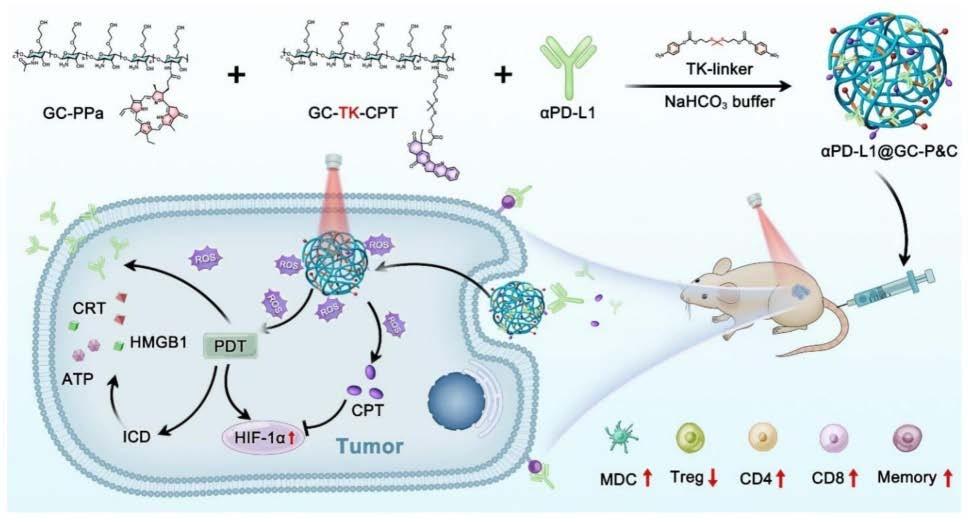
免疫检查点阻断疗法已成为继手术、放疗、抗血管生成和靶向治疗之后癌症治疗的重要治疗手段之一,其通过阻断免疫抑制因子或其受体的表达,增强抗肿瘤T细胞应答,从而增强抗肿瘤免疫。光动力疗法(PDT)诱导的免疫原性细胞死亡可以刺激T细胞浸润,增强检查点阻断的免疫效果。上述疗法通过产生大量活性氧(ROS),进而诱导肿瘤细胞表达和释放损伤相关分子模式(DAMPs)。这些DAMPs的慢性暴露会吸引未成熟的树突状细胞(DCs),并与其受体和配体相互作用,激活未成熟DCs向成熟DCs的表型转化。而成熟的DCs能够吞噬细胞并呈递肿瘤抗原,刺激特异性T细胞应答,进一步杀死更多的肿瘤细胞。但是PDT诱导ROS的产生需要耗氧,乏氧的肿瘤微环境(TME)会限制PDT的治疗效果,同时,PDT耗氧会进一步导致TME乏氧,从而促进肿瘤的增殖、侵袭和转移。此外,缺氧可上调缺氧诱导因子1α的过表达,使能量的产生从线粒体来源向糖酵解来源转化,进而增加肿瘤微环境中的能量,平衡氧气的消耗和供应,从而促进肿瘤血管的生成、侵袭、迁移和肿瘤干细胞的自我更新。因此,需要寻求有效的手段,在实现PDT促进免疫检查点阻断的免疫治疗的同时,有效缓解PDT引起的缺氧,从而形成免疫治疗的协同闭环治疗效果,以增强对肿瘤的杀伤力,形成系统的免疫记忆,有效抑制肿瘤的侵袭和转移。为了克服现有技术的不足,本成果将抗血管生成药物前药通过缩硫酮键、光敏剂通过酰胺键与乙二醇壳聚糖连接,并在活性氧响应型交联剂的作用下偶联抗体形成纳米递药系统,进而制得一种光激活的交联蛋白前药纳米递药系统。本成果的方法具有制备条件温和、简单、局部靶向等优势,并成功实现了PDT、免疫治疗和抗血管生成的协同闭环治疗,为抗肿瘤协同治疗提供了新的策略。
合作需求
技术转让、合作研发
成果二:一种pH响应电荷翻转纳米递药系统的构建及其应用
所属领域
生物医药
成果简介
奥沙利铂属于二价铂类抗肿瘤药物,适应症广,抗肿瘤效果良好,已被广泛应用于多种恶性肿瘤的临床治疗。但是奥沙利铂靶向性差,有强烈的剂量限制性毒性,严重限制了其临床应用。为了解决奥沙利铂在肿瘤治疗中靶向性差、毒副作用大等问题以及调整肿瘤微环境的免疫抑制情况,本成果提出了一种pH响应电荷翻转纳米递药系统的构建方法。本成果合成了多巴胺修饰的奥沙利铂前药(OXA-DA),利用OXA-DA制备多孔纳米粒,将奥沙利铂镶嵌于纳米粒内部,提高了奥沙利铂在循环系统中的稳定性、改变机体组织分布并减少毒副作用。其次,将铁死亡诱导剂分散于纳米粒表面介孔内,并在纳米粒表面修饰pH敏感的功能肽PEGH8,致使该纳米递药系统在肿瘤微环境中发生电荷翻转,增强纳米粒的摄取效率并实现细胞内溶酶体逃逸。本成果所构建的纳米递药系统在pH较低的肿瘤微环境中,能够发生电荷翻转,提高纳米制剂在肿瘤细胞内的摄取效率,同时能够有效诱导肿瘤细胞发生铁死亡并诱导ICD效应,并结合多巴胺的光热效应实现化疗/光热/免疫三重抗肿瘤作用,有望发展作为新型抗肿瘤制剂用于恶性肿瘤的临床治疗。

合作需求
技术转让、合作研发
成果三:一种天然多酚构成的免疫检查点抑制剂纳米递送系统及其制备方法
所属领域
生物医药
成果简介
PD-L1免疫检查点是肿瘤抑制免疫系统起效的主要靶点之一,目前通过PD-L1抗体进行肿瘤治疗具有相对最为成熟的研究体系和临床应用。然而,由于多种免疫逃逸机制的存在,单一免疫检查点靶点的阻断(如PD-1/PD-L1)所能带来的治疗效果十分有限,且具有明显的个体差异。同时,由于免疫检查点(如PD-L1)在正常组织细胞中分布比较广泛,其所带来的全身毒性问题也逐渐显露出来。此外,目前临床治疗中使用免疫检查点抗体全身注射所需的剂量较大,花费极高。为了解决上述问题,本成果提出了一种天然多酚构成的免疫检查点抑制剂纳米递送系统,所制备的纳米复合物不仅含有PD-L1抗体,其载体的主要成分山竹子素还可以通过抑制NF-κB通路提高免疫治疗的效果。本成果以透明质酸为基底制备纳米载体实现PD-L1抗体的递送,能够靶向性地与肿瘤部位的CD44受体特异结合,从而降低PD-L1抗体所产生的毒副作用。由于能特异性地将PD-L1抗体递送到肿瘤部位,在保证肿瘤局部达到相同浓度的情况下,可以大大减少PD-L1的注射剂量,在进一步降低产生不良反应的风险的同时,大大减少治疗费用。
合作需求
技术转让、合作研发
成果四:一种光激活的交联蛋白前药纳米递药系统的制备及其应用
所属领域
生物医药
成果简介
黏膜表面作为抵御病原体入侵的第一防御系统起着关键作用,该系统由物理、化学、生物和免疫屏障组成。其中,黏膜免疫屏障主要由分泌型IgA(sIgA)、细胞因子、黏膜相关淋巴组织(MALT)以及弥漫性先天性和适应性免疫细胞形成。通过黏膜疫苗的接种,可以诱导黏膜相关免疫细胞的增殖和功能调节,以及黏膜免疫组织的形成。黏膜疫苗的免疫保护可以降低感染率、减少疾病的严重程度和持续时间,并在流行病学上起到控制和防治疾病的作用。本成果提供了一种诱发黏膜免疫应答的微针贴片疫苗,将壳聚糖寡糖包裹的DNA纳米颗粒与微针技术创造性地结合在一起,并证明该策略可在肺脏等黏膜组织诱发强效的抗原特异性免疫应答。该技术可普遍应用于研发预防黏膜途径感染病原体(例如新冠病毒等)的新型黏膜疫苗。本成果提供的疫苗具有足够的机械强度来刺穿皮肤,从而输送纳米颗粒疫苗进入体内皮下组织和细胞,且其溶解效率较高,稳定性较好。本发明以微针模板倒模制备疫苗,方法简单,操作方便,价格低廉,可重复利用,不需要很高的技术要求,且易对微针阵列的基本形貌进行控制,安全性强,适宜推广。
合作需求
技术转让、合作研发
成果五:一种近红外光/酶程序性激活超分子前药系统及制备方法
所属领域
生物医药
成果简介
表皮生长因子受体(EGFR)突变是非小细胞肺癌最常见的突变。目前,酪氨酸激酶抑制剂(TKIs)能给EGFR突变的非小细胞肺癌(NSCLC)患者带来显著的临床治疗效果。2003年5月,吉非替尼(GEF)成为首个被FDA批准的靶向药,开启了TKIs用于治疗EGFR突变NSCLC患者的新时代。然而,TKIs在用药9-12个月之后,不可避免出现耐药现象,进而严重降低了临床治疗效果。TKIs的耐药性成为临床上亟待解决的问题。而GEF的耐药机制一般可以分为靶内机制和靶外机制,其中,后者主要包括EGFR信号传导路径的变化以及EGFR的旁路激活效应。为此,研究者们致力于开发新的小分子抑制剂或者单抗药物,以降低NSCLC患者的耐药性。然而,开发新的小分子抑制剂或者单抗药物不仅耗时耗力,还面临适用性较窄的问题。因此,如何科学设计载药体系和药物协同作用抑制旁路激活对临床治疗NSCLC具有重大意义。本成果开发了基于主客体作用的新型超分子纳米前药递送系统HA-BPY-GEF-PNs,该纳米载药系统具有近红外光照和组织蛋白酶B内外源性程序性激活效应的特点,为响应性纳米载药系统的设计提供了新的思路。本成果开发的新型超分子纳米前药递送系统HA-BP-GEF-PNs,载体安全性高,生物相容性好,肿瘤细胞摄取能力强,药物释放精准可控,能够实现更高的治疗精准度,减少毒副作用。此外,在本成果的新型超分子纳米前药递送系统HA-BPY-GEF-PNs中,光敏剂的掺入,一方面提供了光动力治疗(PDT)作用,另一方面可以通过提高肿瘤细胞内的ROS来抑制旁路激活信号通路,进而对耐药细胞产生较大毒性,为克服非小细胞肺癌产生的耐药问题提供了新的解决思路。

合作需求
技术转让、合作研发
如您有成果发布或成果对接意向,欢迎联系
秦杰
020-84112410,13560237601
陈湘鹏
020-84115268,15875072084